Buckland-Nicks, J.A., Gillis, M., Reimchen, T.E., 2012. Neural network detected in a presumed vestigial trait: ultrastructure of the salmonid adipose fin. Proceedings of the Royal Society B-Biological Sciences 279, 553-563.
Candiotto, A., Bo, T., Fenoglio, S., 2011. Biological and ecological data on an established rainbow trout (Oncorhynchus mykiss) population in an Italian stream. Fundamental and Applied Limnology 179, 67-76.
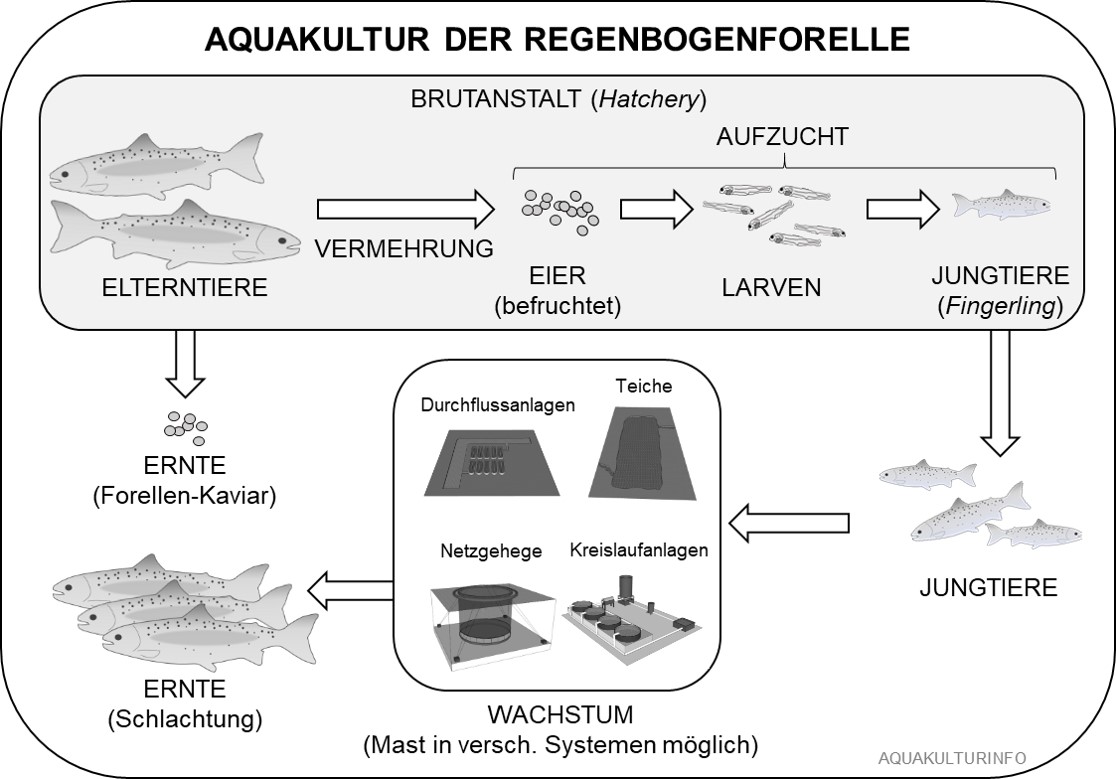
Cowx, I.G., 2005. Cultured Aquatic Species Information Programm. Oncorhynchus mykiss. Cultured Aquatic Species Information Programme. FAO Fisheries and Aquaculture Department, Rome.
d'Orbcastel, E.R., Blancheton, J.P., Aubin, J., 2009. Towards environmentally sustainable aquaculture: Comparison between two trout farming systems using Life Cycle Assessment. Aquacultural Engineering 40, 113-119.
Dalsgaard, J., Lund, I., Thorarinsdottir, R., Drengstig, A., Arvonen, K., Pedersen, P.B., 2013. Farming different species in RAS in Nordic countries: Current status and future perspectives. Aquacultural Engineering 53, 2-13.
Estay, F.J., Noriega, R., Ureta, J.P., Martin, W., Colihueque, N., 2004. Reproductive performance of cultured brown trout (Salmo trutta L.) in Chile. Aquaculture Research 35, 447-452.
Fausch, K.D., Taniguchi, Y., Nakano, S., Grossman, G.D., Townsend, C.R., 2001. Flood disturbance regimes influence rainbow trout invasion success among five holarctic regions. Ecological Applications 11, 1438-1455.
Fausch, K.D., 2007. Introduction, establishment and effects of non-native salmonids: considering the risk of rainbow trout invasion in the United Kingdom. Journal of Fish Biology 71, 1-32.
Fischer, G.J., Held, J., Hartleb, C., Malison, J., 2009. Evaluation of brook trout production in a coldwater recycle aquaculture system. Aquacultural Engineering 41, 109-113.
Fischinformationszentrum (FIZ), https://www.fischinfo.de/ [05/2019]
Fraser, T.W.K., Fjelldal, P.G., Hansen, T., Mayer, I., 2012. Welfare Considerations of Triploid Fish. Reviews in Fisheries Science 20, 192-211.
Fuller, P., J. Larson, and A. Fusaro. 2013. Oncorhynchus mykiss. USGS Nonindigenous Aquatic Species Database, Gainesville, FL.
http://nas.er.usgs.gov/queries/factsheet.aspx
Gjedrem, T., Robinson, N., Rye, M., 2012. The importance of selective breeding in aquaculture to meet future demands for animal protein: A review. Aquaculture 350, 117-129.
Good, C., Davidson, J., Welsh, C., Brazil, B., Snekvik, K., Summerfelt, S., 2009. The impact of water exchange rate on the health and performance of rainbow trout Oncorhynchus mykiss in water recirculation aquaculture systems. Aquaculture 294, 80-85.
Kato, K.; Yanagawa, T., 2000. A reproductive population of rainbow trout introduced into the Sanjo river, western Japan. Japan Aquaculture Society Aquaculture Society, Suisan Zoshoku 48; 603-608
Pankhurst, N.W., Dedual, M., 1994. Effects of Capture and Recovery on Plasma-Levels of Cortisol, Lactate and Gonadal-Steroids in a Natural-Population of Rainbow-Trout. Journal of Fish Biology 45, 1013-1025.
Sindilariu, P.D., Reiter, R., Wedekind, H., 2009. Impact of trout aquaculture on water quality and farm effluent treatment options. Aquatic Living Resources 22, 93-103.
Soto, D., Arismendi, I., Gonzalez, J., Sanzana, J., Jara, F., Jara, C., Guzman, E., Lara, A., 2006. Southern Chile, trout and salmon country: invasion patterns and threats for native species. Revista Chilena de Historia Natural 79, 97-117.
Tusche, K., Arning, S., Wuertz, S., Susenbeth, A., Schulz, C., 2012. Wheat gluten and potato protein concentrate - Promising protein sources for organic farming of rainbow trout (Oncorhynchus mykiss). Aquaculture 344, 120-125.
Weber, E.D., Fausch, K.D., 2003. Interactions between hatchery and wild salmonids in streams: differences in biology and evidence for competition. Canadian Journal of Fisheries and Aquatic Sciences 60, 1018-1036.
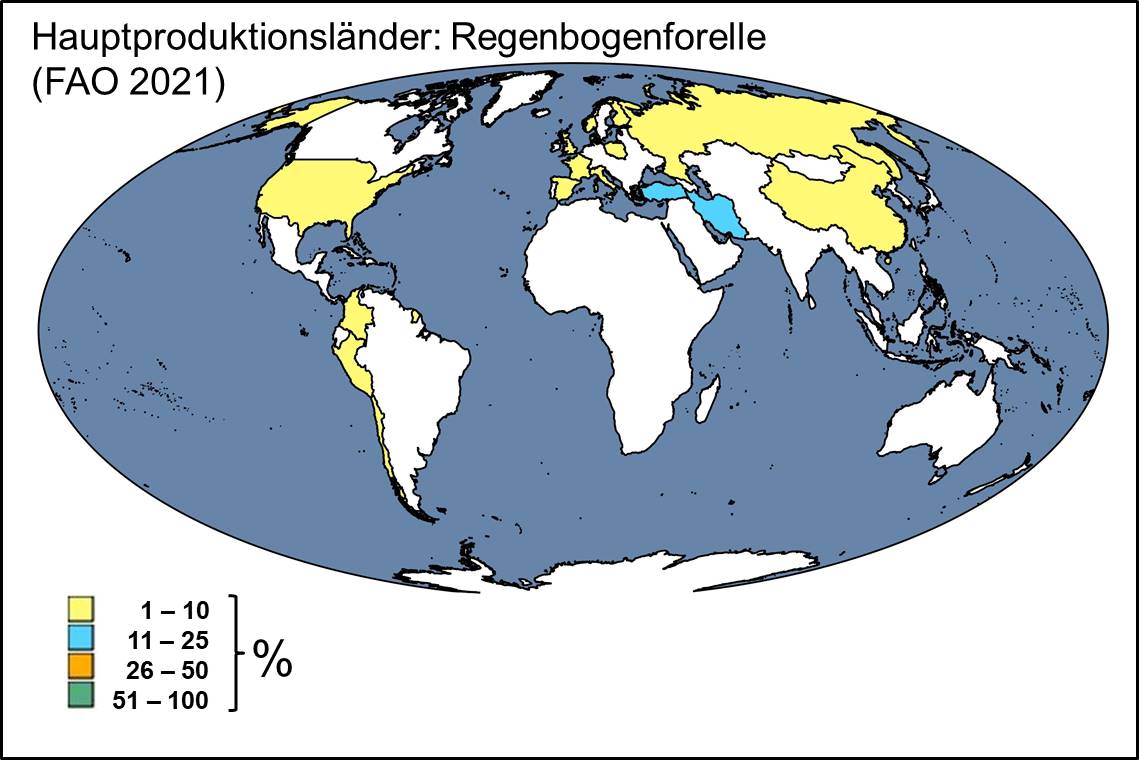
Produktionsstatistiken: Food and Agriculture Organisation of the United Nations (FAO); FIGIS (online database for aquaculture production; http://www.fao.org/fishery/statistics/global-aquaculture-production/query/en)
[Stand 05/2019]